重磅!阿兹夫定纳入新冠诊疗方案初定价格每瓶不超300元用法用量
发布时间:2023-12-26 作者: 常见问题
原标题:重磅!阿兹夫定纳入新冠诊疗方案,初定价格每瓶不超300元,用法用量
8月9日,国家卫生健康委办公厅、国家中医药局办公室发布通知称,依照国家药监局附条件批准阿兹夫定片增加治疗新冠病毒肺炎适应症注册申请的审批意见,为加强完善新冠病毒肺炎抗病毒治疗方案,经研究,将该药纳入《新冠病毒肺炎诊疗方案(第九版)》。用来医治普通型新冠病毒肺炎(COVID-19)成年患者。
使用该药品前应详细阅读国家药监局核准的《阿兹夫定片说明书》,按照说明书规定的适应症、用法用量正确使用药品。患者应在医师指导下用药。医师开具该药品前要熟知禁忌症、不良反应、药物的相互作用等,并详细询问患者的药物过敏史等情况,避免有禁忌症的患者使用。各地要严格按照《药品不良反应报告和监测管理办法》要求,做好不良反应监测和报告工作,确保用药安全。
此前,据新闻媒体报道,记者从河南真实生物科技有限公司获悉,目前,治疗新冠肺炎的阿兹夫定片价格初定,每瓶不到300元,每瓶35片,每片1mg。
7月25日,国家药监局根据《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准河南真实生物科技有限公司阿兹夫定片增加治疗新冠病毒肺炎适应症注册申请。这在某种程度上预示着,阿兹夫定片成为国内首款自主研发的口服小分子新冠治疗药物。
横向对比看,阿兹夫定片的价格上的优势明显,若后期纳入医保并得到规模化生产,其价格可能还会促进降低。
据红星新闻,回顾阿兹夫定片的上市历程,像是驶入了快车道,三周时间完成了从递交上市申请到量产。
7月15日,真实生物宣布正式向国家药品监督管理局提交上市申请后,7月25日,国家药监局附条件批准阿兹夫定片增加治疗新冠病毒肺炎适应症注册申请,这也代表着,真实生物成为首个国产新冠口服药厂商。8月2日,真实生物在平顶山举办“新冠口服药阿兹夫定片投产仪式”,阿兹夫定片郑重进入投产阶段。
阿兹夫定片宣布投产后,紧接着,8月4日,真实生物向港交所递交首次公开募股(IPO)申请书。
天眼查资料显示,线年,注册地在河南平顶山,是一家集研发和生产为一体的具有自主知识产权的生物医药企业,主要致力于抗病毒和抗肿瘤药物、心脑血管以及肝脏疾病等治疗药物的研发,旗下还有一家注册在深圳的100%控股子公司——深圳真实生物医药科技有限公司。
真实生物招股书称,公司核心产品阿兹夫定为具有广谱抗病毒活性的创新药物,已分别于2021年7月及2022年7月获国家药监局附条件批准用来医治HIV感染及COVID-19,为中国公司研发的首个获国家药监局批准用来医治COVID-19的口服直接抗病毒药物。公司称已做好充分准备以启动阿兹夫定的商业销售。
而上市募资投向之一,便是公司核心产品阿兹夫定治疗COVID-19的制造及商业化,大多数都用在为采购阿兹夫定商业化生产所需的医药原料提供资金,及用于为扩大平顶山生产厂房的产能提供资金。
此外,募集资金也将部分用于阿兹夫定治疗HIV感染、HFMD及若干类型血液肿瘤的临床开发,全口服长效复方片剂(阿兹夫定╱CL-197)用来医治HIV感染的计划中临床试验,临床前或IND阶段候选药物的临床开发,加强研发平台及扩大产品管线等。
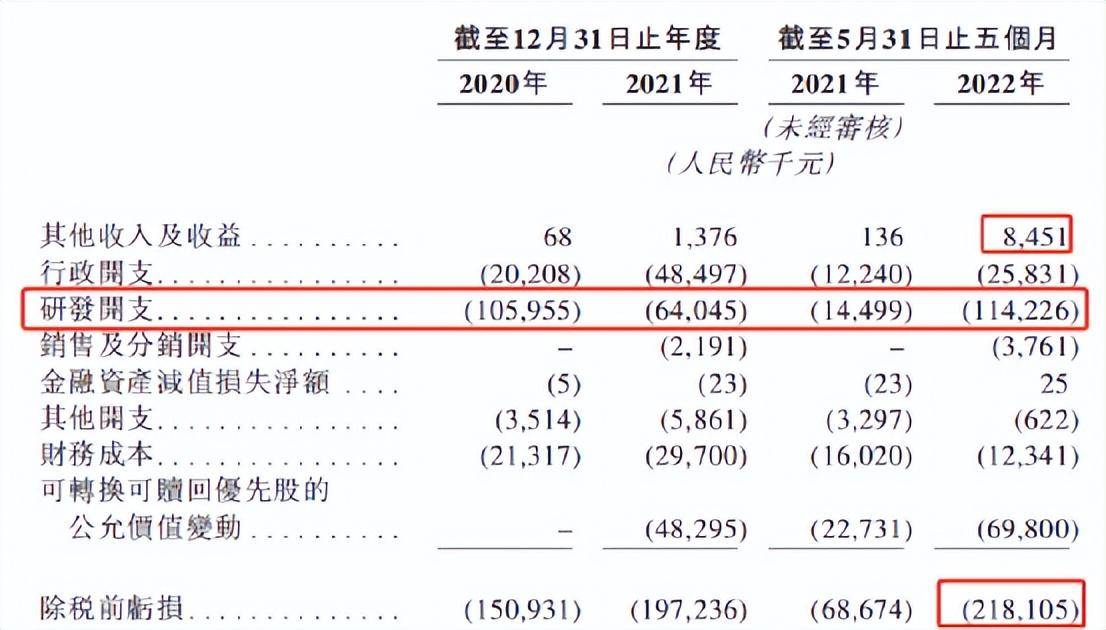
目前,真实生物尚未有收入,于往绩记录期间,企业主要通过股权融资以及贷款及其他借款来满足运用资金要求。从财务数据分析来看,2020年、2021年及2022年前5月,公司另外的收入及收益分别是6.8万元、137.6万元、845.1万元,亏损分别为1.51亿元、1.97亿元、2.18亿元,也就是说近两年半亏损总计5.66亿元。
在此期间,真实生物的研发开支分别为1.06亿元、0.64亿元和1.14亿元。截至2022年5月31日,真实生物的内部开发团队为41名成员。对此,真实生物直言不讳地指出,“我们是一家尚未有收入的公司,主要是做药物研发活动,研发对于业务成长及经营成功至关重要。”
招股书显示,真实生物已委聘独立第三方北京协和生产阿兹夫定。而为筹备阿兹夫定的商业化,已与中国数家领先药品制造商(包括北京协和)订立战略协议。同时,真实生物指出,其自身具备总建筑面积22262平方米的自行生产能力,年产能约为十亿片剂阿兹夫定,并计划寻求将阿兹夫定列入中国国家医保目录。
图片丨真实生物科技公众号截图、国家卫健委官网截图、招股书截图、河南省人民政府网站截图、视觉中国返回搜狐,查看更加多





 扫一扫 手机预览
扫一扫 手机预览
 返回
返回



